|
Studieuppgifter

Atom och kärnfysik
Begrepp att känna till och kunna använda i dina diskussioner
- Subatomära partiklar protoner, neutroner och elektroner
- Masstal
- Atomnummer
- Grundtillstånd
- Exiterat tillstånd
- Kontinuerligt spektrum
- Linjespektrum
- Absorbtionsspektrum
- Elektromagnetiska vågor
- Röntgen
- Radioaktivitet
. Alfa, beta och gammastrålning
- Deuterium (väteisotop)
- Tritium (väteisotop)
- Halveringstid
- Enheter för sönderfall becquerel
- Fission
- Fusion
Atomen
När man ritar en atom använder vi en modell som kallas för planetmodellen. Det var den danske fysiken Niels Bohr som kom på iden till denna atommodell. I Bohrs modell finns tre subatomära partiklar, protoner, neutroner och elektroner. För att atomen skall vara neutral, alltså ingen laddning, finns lika många protoner (+) som elektroner (-).
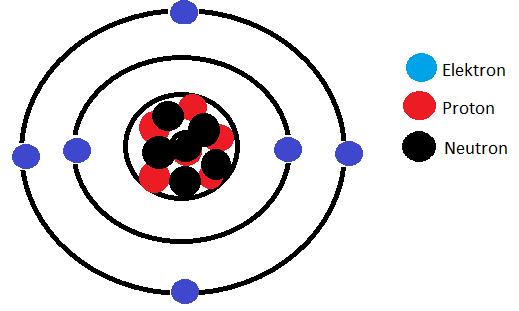
Detta är en kolatom. Den är uppbygd av 6 protoner, 6 neutroner och 6 elektroner
Atomnummer
I en atom är det protonen och neutronen som väger, har massa. Elektronen har i stort sett ingen massa om man jämför med protoner och neutroner. Atomnumret säger hur många protoner det finns i en atomkärna. På detta vis vet du också hur många elektroner det finns runt kärnan eftersom atomen saknar leddning.
13Al Aluminium har atomnummer tretton.
Masstal
Masstalet anger hur många protoner och neutroner det finns i atomkärnan. Genom att subtrahera atomnumret med masstalet får du fram antalet neutroner i kärnan. Masstalet är siffran som är upphöjd framför det kemiska tecknet. Kol har atomnummer 6 och masstalet 12.
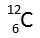
Grundtillstånd
Elektronerna befinner sig i sina elektronbanor. Beroende på vilken energi elektronen har, har de lika avstånd till atomkärnan, de befinner sig i olika skal beroende på vilken energi elektronerna har. En atom som har sina elektroner i sina ordinarie, vanliga, banor sägs befinna sig i sitt grundtillstånd.
Exciterat tillstånd
Elektronerna i kan ta upp energi från omgivningen. Detta utnyttja man i bland annat lysrör. I lysröret finns argongas och förångad kvicksilver. När man låter ström passera genom gasen tar elektronerna upp energin. Elektronerna får då högre energi. Elektronerna hoppar då ut till en elektronbana längre ut. Detta tillstånd kallas exciterat tillstånd. en exciterad atom kan är mycket reaktiv och behåller tillståndet en bråkdels sekund.
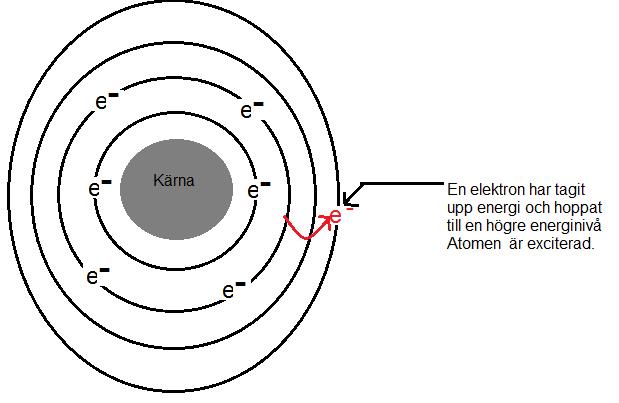
När elektronen inte längre kan behålla energin släpper den energin i form av en partikel som kallas för foton eller ljusblixt. samtidigt som den släpper energin faller den tillbaka till sin normala elektronbana, alltså till sitt grundtillstånd. Att vi ser konstant ljus från ett lysrör beror på att miljarder och åter miljarder av exciterade atomer ger upphov till ett ljus som vi upplever konstant och inte som ljusblixtar.
Spektrum
Ett spektrum skall ses som en uppdelning av elektromagnetiska vågor. På detta vis kan man få ljuset att dela upp sig i regnbågens alla färger.
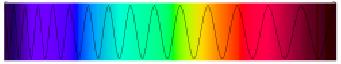
Bild från wikipedia
Ljus från solen har våglängder från alla färger som människan kan se. Då ljuset delar upp sig när den passerar en prisma kan man se all färgerna i spektret. Detta spektra kallas för kontinuerligt spektra. Ljus med alla färgerna upplevs av människan som vitt ljus.
Om ljus med kontinuerligt spektra får passera en gas och sedan passera en prisma uppstår ett absorptionsspektra. Vissa färger har absorberats och därför framträder inte alla färger. På de platser där de absorberade färgerna skulle varit finns nu mörka sträck.

Om en upphettad gas ger från sig ljus med ett fåtal våglängder får man emissionsspektrum. endast ett fåtal våglängder avges. I spektret uppstår emissionslinjer i de färger som varje våglängd står för.

Elektromagnetiska vågor
Elektromagnetska vågor är en vågrörelse. Beroende på vilken våglängd den elektromagnetiska vågorna har kallas de olika.
Namn Våglängd
Radiovågor Över en meter
Mikrovågor Ca 1mm-1m
Infraröd strålning mindre än 0,1mm
Synligt ljus 400-800nm
Ultraviolett 100-1nm
Röntgen 0,01nm
Gammastrålning 0,001nm
Röntgen
Wilhelm Röntgen fick 1895 nobelpriset för sin upptäckt om röntgenstrålarna. Det han kom på var att elektromagnetisk strålning går igenom kroppens mjuka vävnader men inte benen. På detta vis kunde man se om något var brutet.
Radioaktivitet
Viktiga personer att känna till är Henri Becquerel samt Marie och Pierre Curie. Henri kom på att atomkärnorna faller sönder och sänder ut strålning. Marie och Pierre kom på grundämnet radium som utsänder mycket starkare strålning än uran.
En atomkärna som inte är stabil faller sönder och avger olika typer av radioaktivitet. Nedan faller uran 238 sönder till en heliumkärna och en toriumkärna. Alfastrålning består alltså av heliumkärnor. Även om alfastrålning är farligt når den inte speciellt långt, den stoppas av ett tunt papper.
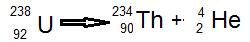
Betastrålning består av elektroner. Denna strålning når längre och är svårare att stoppa. Dock räcker en tjockare träbit. Elektronerna kommer från kärnan. Detta är möjligt då neutronen är uppbyggd av en proton och en elektron.
Gammastrålning är inte materia utan elektromagnetisk strålning. Denna strålning är joniserande vilket betyder att den ger joner. Joner i sin tur kan orsaka cancer. alfa och betastrålning är också joniserande.
Isotoper
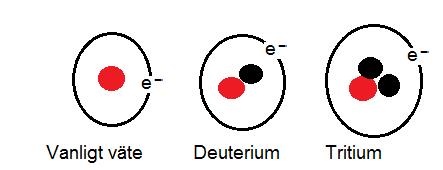
Väte är vårt minsta grundämne. Vanligen består den av en proton i kärnan och en elektron som cirkulera runt kärnan. Det finns andra typer av väte. Dessa kallas för isotoper. Vätets isotoper har neutroner i kärnan. Deuterium har en neutron i vätekärnan. Tritium har två neutroner i vätekärnan. Både tritium och deuterium är tyngre än vanligt väte. Om en vattenmolekyl är uppbyggt av deuterium eller tritium istället för vanligt väte kallas det för tungt vatten.
Tillbaka
|