|
Syror och Baser
الأحماض والقواعد
När man hör ordet syra tänker man nästan alltid direkt på de farliga starka syrorna. Men visst är det så att det är de svaga syrorna som är de vanligaste i vår omgivning. Du hittar svaga syror i frukter, maten, och mediciner. Naturen producerar sina egna syror och ger alla frukter sin typiska surhet i smaken.
عندما تسمع كلمة حمض سيكون تقريبا دائما على حق في الأحماض القوية الخطرة. ولكن ليس على النحو الذي يجعلها هو الأحماض الضعيفة التي هي الأكثر شيوعا في بيئتنا. يمكنك العثور على أحماض ضعيفة في الفواكه والمواد الغذائية والأدوية. طبيعة تنتج الأحماض الخاصة بها ، ويقدم كل ثمرة حموضته مميزة في الطعم
Alla syror innehåller väte
تحتوي على جميع الأحماض الهيدروجين
Om du tittar på strukturformlerna nedan ser du att alla syrorna har atomen väte gemensamt.
اذا نظرتم الى الصيغ الهيكلية أدناه ، سترى أن جميع الأحماض وذرة الهيدروجين في المشترك.
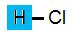 Saltsyra Saltsyra
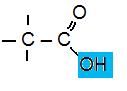 Ättiksyra Ättiksyra
När en syra "fräter" lämnar de ifrån sig sina väten. I kemin kallar vi dessa väten för protoner.
عندما حمض "يأكل" يترك له بالتسجيل في الهيدروجين. في الكيمياء ، فإننا ندعو هذه الكربونات إلى البروتونات
HCl + H2O --> H3O+ + Cl-
Saltsyra + Vatten --> oxoniumjon + klorjon
Svaga syror
أحماض ضعيفة
De svaga syrorna är inte lika farliga som de starka men kan ändå irritera hud och slemhinnor. Syrorna har länge använts i matlagning som ett konserveringsmedel. Bakterierna som gör att maten blir fördärvad med tiden trivs inte i sur miljö. Det som skiljer svaga syror från starka syror är att deras protoner inte avges lika lätt. Om du blandar saltsyra i vatten kommer nästan alla saltsyramolekyler att avge sina protoner. Löser du en svag syra kommer denna reaktion att ta mycket längre tid och därför är svaga syror mindre reaktiva än starka syror.
حموضة ضعيفة ليست خطيرة مثل قوية ولكن لا يزال يمكن أن تثير غضب الجلد والأغشية المخاطية. منذ فترة طويلة والأحماض المستخدمة في الطبخ كمادة حافظة. إلى إعطابها والجراثيم التي تسبب الغذائي مع مرور الوقت لا تزدهر في البيئة الحمضية. ما يميز أحماض ضعيفة من الأحماض القوية هي التي لا تنبعث البروتونات على أنها ضوء. إذا كنت مزيج حمض الهيدروكلوريك في المياه ، ما يقرب من جميع جزيئات حمض البروتونات للادلاء بها. حل حمض ضعيف ، وهذا رد فعل على وقتا أطول ، وبالتالي هي أحماض ضعيفة أقل نشاطا من الأحماض القوية.
Ex på svaga syror
Askorbinsyra = vitamin C
vinsyra = används i saft och sylt
acetylsalicylsyra
مثال على أحماض ضعيفة
حمض الاسكوربيك فيتامين ج =
= حيوانات تستخدم في العصائر والمربيات
الأسبرين
Saltsyra HCl
حمض الهيدروكلوريك حمض الهيدروكلوريك
Saltsyra är en av de starka syror vi använder oss av. Saltsyrans molekyl består av en väteatom samt en kloratom. Saltsyra används tilll mineralfoder för husdjur men fungerar samtidigt mycket bra till tvättning av husfasader samt rengörning av metaller då man vill ta bort metalloxider.
حمض الهيدروكلوريك هو واحد من الأحماض القوية التي نستخدمها. ملح حامض جزيء يتكون من ذرة الهيدروجين وذرة الكلور. يستخدم حامض الهيدروكلوريك مقدمة للالملحق المعدنية للثروة الحيوانية ، ولكن يعمل أيضا بشكل جيد للغاية لغسل واجهات المباني وتنظيف المعادن عندما تريد إزالة أكاسيد المعادن.
Saltsyra i koncentrerad form är färglös men sticker i näsan om man andas in den. Detta beror på att koncentrerad saltsyra gärna går upp i gasform.
حمض الهيدروكلوريك في شكل مركز وعديم اللون ، ولكن الخلاف أنفك إذا كنت تتنفس منه. وذلك لأن حامض تتركز هويكون يفضل أن في شكل غازي.
Vi har en del saltsyra i magen. Denna används för att vi ska kunna bryta ned maten vi äter.
لدينا واحدة من حمض الهيدروكلوريك في المعدة. وهذا بالنسبة لنا لكسر الطعام الذي نأكله
När du späder saltsyra med vatten bildas följande joner.
عندما حمض الهيدروكلوريك المخفف بالماء تشكيلها عقب الأيونات
H2O + HCl --> H3O+ + Cl-
Vatten + saltsyra --> Oxoniumjon + klorjon
Svavelsyra H2SO4
حمض الكبريتيك H2SO4
Svavelsyra är uppbyggt av en svavelatom, 4 syre matomer och två väteatomer som släpper när syran fräter. Titta man på syran är den färglös men mer trögflytande än de andra syrorna vi arbetar med i kemin.
De syror vi har i kemin är utspädda med vatten. Dvs de är inte koncentrerade. När man späder svavelsyra är det viktigt att man gör det i rätt ordning. Man häller alltid i syran i vattnet när man späder. Anledningen till detta är att alla svavelsyramolekylerna kommer att lämna från sig sina väten (Protoner) och då är det bra om man bara tillför lite svavelsyra i taget. Känner man på bägaren som man spätt syran i är den betydligt varmare än när den var innan man spädde syran.
يتكون حمض الكبريتيك يتكون من ذرة واحدة من الكبريت والاوكسجين قياس مدى أربعة واثنين من ذرات الهيدروجين التي تم إصدارها عندما الحامض إلى تآكل. نتطلع إلى حمض عديم اللون ، ولكن أكثر لزوجة من الأحماض الأخرى ونحن نعمل في الكيمياء.
هو تمييع الأحماض لدينا في الكيمياء مع الماء. وهذا يعني أنها ليست مركزة. عند حمض الكبريتيك المخفف ، من المهم أن تفعل ذلك في الترتيب الصحيح. كنت دائما صب الحامض في الماء عند مخفف. والسبب في ذلك هو ان جميع جزيئات حمض سيغادر في حد ذاتها من الهيدروجين (البروتونات) ، ثم انها جيدة إذا قمت بإضافة مجرد حامض الكبريتيك قليلا في وقت واحد. تشعر أنها في كأس لأنها تضعف الحامض فيه أكثر دفئا بكثير مما كان عليه قبل أضافت لك الحامض
SIV-regeln Syra I Vatten
سيف القاعدة الحمضية في المياه
När man späder svavelsyra i vatten bildas följande joner
عند حمض الكبريتيك المخفف في الماء تشكيلها عقب الأيونات
H2O + H2SO4 --> H3O++ HSO4-
Vatten + svavelsyra --> oxoniumjon + vätesulfatjon
Vätesulfatjonen är en svag syra men kan avge sitt enda väte till en bas.
أيون الهيدروجين سلفات هو حمض ضعيف لكنه يمكن أن يحقق لها الهيدروجين واحد إلى قاعدة
Svavelsyra är en viktig kemikalie Den används i tillverkningen av gödsel, färgämnen och sprängämnen som nitroglycerin. Den används också när man skall tillverka saltsyra och fosforsyra.
حمض الكبريتيك مادة كيميائية هامة تستخدم في صناعة الأصباغ والأسمدة والمتفجرات النيتروجلسرين. كما انها تستخدم عند يجب إنتاج حمض الهيدروكلوريك وحمض الفوسفوريك
Salpetersyra HNO3
حمض النتريك HNO3
Salpetersyra är också en färglös vätska. Som du kanske märkt har jag denna syra i en mörk flaska. Det är för att syran reagerar på ljus och faller då sönder. Detta kan man märka om syran är gulfärgad.
حمض النتريك هو سائل عديم اللون. كما كنت قد لاحظت أن هذا الحمض في زجاجة داكنة. فذلك لأن الحامض يتفاعل مع الضوء ويندرج ثم إربا. هذا يمكنك معرفة ما إذا كان حمض الصفراء
När man späder salpetersyra i vatten bildas följande joner
عند تخفيف حامض النيتريك في الماء تشكيلها عقب الأيونات
H2O + HNO3 --> H3O+ + NO3-
vatten + salpetersyra --> Oxoniumjon + nitratjon
Nitrösa gaser är inte nyttiga att andas in. Salpersyra har egenskapen att bilda sådana när de låts reagerar med vissa metaller.
Störst användning har man av salpetersyra när man skall tillverka amoniumnitrat som är ett gödsel. Man kan också ha salpetersyra till sprängämnen.
أبخرة النيتروز ليست صحية في التنفس. حمض النتريك لديه القدرة على تشكيل مثل أوراق تتفاعل مع بعض المعادن.
وكان أعظم استخدام حمض النتريك عندما لإنتاج نترات الأمونيوم كسماد. يمكن أيضا أن يكون حامض النيتريك بحثا عن متفجرات
4 Viktiga baser
قواعد هامة 4
Man brukar säga att alla syror avger vätejoner (protoner). På samma sätt kan du säga att alla baser tar till sig vätejoner (protoner).
وكثيرا ما يقال بأن جميع الأحماض إنتاج أيونات الهيدروجين (البروتونات). وبالمثل ، هل يمكن القول أن جميع القواعد سوف تأخذ على أيونات الهيدروجين (البروتونات).
Natriumhydroxid NaOH
هيدروكسيد الصوديوم هيدروكسيد الصوديوم
Natriumhydroxiden består av en natriumatom, en syreatom samt en väteatom. I hemmet kan man har den till att lösa proppar i avloppet. När man köper den i butiken kallas den för kaustiksoda. Natronlut är natriumhydroxid löst i vatten.
Som vi sett på lektionen är natriumhydroxid i fast form ett vitt pulver. På vårt laboratorium har vi natriumhydroxiden som små pastiller (tabletter).
ويتكون هيدروكسيد الصوديوم من ذرة الصوديوم وذرة أكسجين وذرة هيدروجين. في البداية هل يمكن أن يكون لها فضفاض المقابس هجرة. عند شراء في مخزن يسمى الصودا الكاوية. الصودا الكاوية هي هيدروكسيد الصوديوم الذائب في الماء.
كما شاهدنا في الدرس هو هيدروكسيد الصوديوم في شكل صلب ، وهو مسحوق أبيض. في المختبر ، لدينا هيدروكسيد الصوديوم ومعينات صغيرة (أقراص).
Natriumhydroxidid löst i vatten (natronlut) är mycket frätande och får man det på sig är det viktigt att omedelbart tvätta sig. Får man det i ögonen måste man skölja noga med vatten samt kontakta en läkare.
Industriellt används matriumhydroxiden till i pappersmassafabrikerna samt till tvålframställnng
هيدروكسيد الصوديوم في محلول مائي (الصودا الكاوية) هو تآكل جدا وتحصل عليه ، فإنه من المهم أن تغسل فورا أنفسهم. هل مسموح به في عينيك ، وشطف جيدا بالماء واستشارة الطبيب.
هيدروكسيد الصوديوم استخدام الصناعي لمصانع اللب ولإنتاج الصابون
Soda Na2CO3
الصودا Na2CO3
Ett annat namn för soda är natriumkarbonat. Soda ingår i tvättmedel då det är smutslösande. En annan egenskap som sodan har är att den löser kalksalter som gör vattnet hårt. på detta vis får tvättmedlet större effekt på smutsen.
Ett stort användningsområde för soda är glastillverkning. Genom att tillsätta soda till sand sänks smältpunkten för sanden.
اسم آخر للالصودا كربونات الصوديوم. يتم تضمين الصودا في المنظفات عندما يكون smutslösande. وهناك سمة أخرى أن الصودا وأنه لا يحل أملاح الكالسيوم التي تجعل الماء العسر. وبهذه الطريقة ، والمنظفات أكثر فعالية في التراب.
ومن بين الاستخدامات الرئيسية من رماد الصودا وصناعة الزجاج. بإضافة الصودا إلى الرمل خفض درجة انصهار الرمال
Kalciumhydroxid Ca(OH)2
هيدروكسيد الكالسيوم الكالسيوم (أوهايو) 2
Denna bas har man bland annat när man luta långan till jul. Kalciumhydroxiden löst i vatten kallas för kalkvatten. Blåser man koldioxid i lösning blir lösningen grumlig. På detta vis kan man använda kalciumhydroxid som indikatorlösning på koldioxidgas.
هذه القاعدة ، من بين أمور أخرى عند الجلوس لانغان لعيد الميلاد. يسمى هيدروكسيد الكالسيوم المذاب في الماء ماء الجير. ضربات لثاني أكسيد الكربون في حل ، والحل هو غائم. بهذه الطريقة يمكنك استخدام هيدروكسيد الكالسيوم كحل مؤشر إلى غاز ثاني أكسيد الكربون
Ammoniak NH3
الأمونيا NH
Ammoniak löser sig lätt i vatten. Den ammoniak vi har i skolan är är ammoniak i gas som lösts i vatten. I och med att den gärna går upp i gasform är det viktigt at tänka på att ha denna i dragskåp. Den ger från sig en stark stickande doft som är direkt farlig att inandas då den angiper slemhinnorna och lungorna.
Ammoniak har en låg kokpunkt -33,4 grader celcius. Därför används ammoniak i flytande form som kylmedel i större kylanläggningar. Ammoniak används industriellt till gödselproduktion och i tillverkningen av salpetersyra.
الأمونيا NH3
الأمونيا يذوب بسهولة في الماء. الأمونيا لدينا في المدرسة هو غاز الأمونيا الذائبة في الماء. كما ترتفع سعيد في الغازية ، من المهم في فكرة وجود هذا في غطاء الدخان. انه يعطي رائحة لاذعة من القوي الذي يشكل خطرا على الفور عندما يستنشق الأغشية المخاطية angiper والرئتين.
الأمونيا لديه نقطة غليان منخفضة -33،4 درجة مئوية. لذلك ، استخدم من الأمونيا في شكل سائل كمبرد كبيرة في أنظمة التبريد. وتستخدم الأمونيا صناعيا لانتاج الأسمدة وإنتاج حامض النيتريك
Hydroxidjonen OH-
أيونات هيدروكسيد أوهايو
Det som är generellt för samtliga baser som lösts i vatten är att det bildas hydroxidjoner.
ومن المسلم به عموما لجميع قواعد الذائبة في الماء على شكل أيونات هيدروكسيد
NH3 + H2O --> NH4+ + OH-
ammoniak + vatten --> ammoniumjon + hydroxidjon
Sura och basiska lösningar
الحمضية والحلول الأساسية
Genelrelt kan man säga att alla sura lösningar har H3O+ jonen gemensamt och alla basiska lösningar har OH- jonen gemensamt.
Nedan jämför jag hur en sur lösning bildas och vilka jonslag som ingår med en basisk lösning.
عموما يمكنك القول بأن كل الحلول وحمض H3O + ايون في جميع الحلول المشتركة والأساسية وأوهايو أيون مشترك.
أقارن أدناه كيف يتم تشكيل حل حامض والأيونات الواردة في محلول قلوي
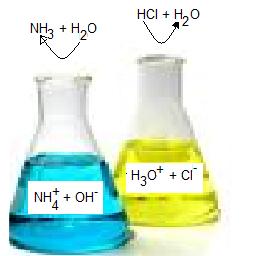
I den gula e-kolven har jag lagt i saltsyra och vatten. Saltsyrans väte avgår till vattenmolekylen H2O som då blir H3O+. + laddningen hos H3O+ bildas då det endast är väteatomens kärna som avges och den är ju positivt laddad. Vätets enda elektron stannar hos kloratomen som då får en elektron extra och blir negativt laddad Cl-.
في مكبس الصفراء الإلكتروني أضع في حمض الهيدروكلوريك والماء. حمض الهيدروكلوريك الهيدروجين يترك جزيء الماء H2O ، الذي يصبح H3O +. ويتكون من H3O + رسم + عند ذرات الهيدروجين هي الأساسية فقط والتي يتم تسليمها لأنها موجبة الشحنة. هيدروجين إلكترون واحد يبقى مع ذرة كلور ، الذي ثم إلكترون اضافي وتصبح سالبة الشحنة الكلور
I den blå e-kolven löser jag ammoniak och vatten. Ammoniak tar gärna en proton från vattenmolekylen. Vattenmolekylen behålller vätets enda elektron och blir OH-.Ammoniakmolekylen blir därgenom NH4+. Ammoniakmolekylen fick en proton till och den är ju positivt laddad, därför blir ammoniumjonen också det.
يمكن في المكبس الزرقاء الإلكترونية يمكنني تصحيح الأمونيا والماء. هل نقدر الأمونيا البروتون من جزيء الماء. جزيء الماء يحتفظ الإلكترون الهيدروجين واحد ويصبح أوه.Ammoniak جزيء يحصل هناك عن طريق NH4 +. وأظهرت الأمونيا جزيء بروتون موجب الشحنة والتي عليه ، كما يصبح أيون الأمونيوم.
Neutral lösning
حل محايد
I sura lösningar finns det alltså gott om H3O+. Det är dessa man mäter när man vill få ett pH-värde på en lösning. Kemister brukar säga att man mäter vätejonskoncentrationen. Detta är en liten felsägning då det egentligen inte finns vätejoner i lösningen utan bara oxoniumjoner. Vätejonen är så reaktiv att den endast kommer att existera någon mikrodels sekund.
حلول الحمضية ، وهناك الكثير من H3O +. هذه هي قياس عندما تريد الحصول على الرقم الهيدروجيني من الحل. الكيميائيين أقول إن كنت قياس vätejonskoncentrationen. هذه هي زلة لسان صغيرة حيث لا يوجد حقا أيونات الهيدروجين في حل ولكن oxoniumjoner فقط. أيونات الهيدروجين والتفاعل بحيث لا توجد إلا في ثانية واحدة صغيرة
I en neutral lösning finns det lika många H3O+ som OH-. pH för en sådan lösning är 7. Sura lösningar är under sju och basiska lösninga ligger på H mellan 7-14
ثانيا ، التوصل إلى حل محايد ، وهناك العديد من مثل H3O + أوهايو. الرقم الهيدروجيني لهذا الحل هو 7. هي محاليل حمضية لمدة سبعة والحلول الأساسية هي بين 7-14 ه
Indikatorer
المؤشرات
En indikataor är ett ämne som reagerar på sura och basiska lösningar. I kemiundervisningen har du varit i kontakt med två stycken indikatorer, BTB och fenolftalein.
Båda dessa ändrar färg beroende på om det är en basisk eller sur lösning.
وindikataor هو المادة التي يتفاعل مع حلول الحمضية والأساسية. الكيمياء في التعليم هل كان لديك اتصال مع اثنين من المؤشرات ، BTB ، والفينول.
كل من هذه يتغير لون اعتمادا على ما إذا كان هو القلوية أو المحاليل الحمضية
BTB i sur, neutral och basisk lösning

Bilden är från wikipedias artikel om BTB
Fenolftalein från vänster pH mindre än 0, till höger pH mer än 12
|