Elektrokemi
1. På vilket sätt bildas joner?
Svar: Alla våra atomer eller grundämnen har olika förmåga att ta till sig elektroner eller lämna från sig elektroner. På detta vis bildas laddade atomer eller joner som de annars heter.
2. Vad kan du utläsa ur spänningsserien?
Svar: Ur spänningsserien kan du utläsa vilka atomer som kommer att ge från sig eller ta emot elektroner. Man kan också få ett hum om spänningen blir stor när man tillverkar ett galvaniskt element med olika metaller. Oädla metaller blir enklare till joner än ädla metaller.

3. Vilka metaller är ädla och vilka metaller är oädla?
Svar: Som du ser i bilden kan man räkna de blåfärgade metallerna till de oädla och de gula till de ädla metallerna. Ju längre de befinner till vänster i spänningsserien ju mer oädel.
4. Så vad händer i naturen när man låter ett obehandlat järnmaterial ligga ute?
Svar: Vi har alla sett hur olika metall material rosta sönder. Jag illustrerar här ett försök där jag låter en obehandlad järnspik ligga i en lösning med kopparjoner och sulfatjoner.
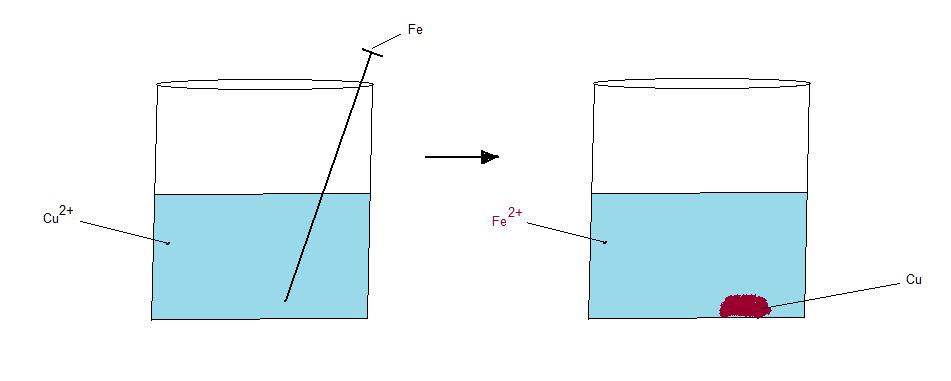
Det som sker med järnatomerna när de ligger i lösning med kopparjoner är att kopparjonerna kommer att ta elektroner från järnatomen. Detta gör den för att koppar är mer ädelt än järn. Järn har större benägenhet att vara i jonform än kopparatomen. Järnatomen går då ut i lösning som järnjon ( Fe2+) Kopparjonen har då reducerats till kopparatom (Cu). Det kommer att bildas ett skikt med kopparatomer på botten av bägaren.
5. Vad menas med oxidation
Svar: Med oxidation menas givande av elektroner
Fe 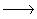 Fe2+ + 2e- Oxidation
Fe2+ + 2e- Oxidation
6. Vad menas med reduktion
Svar: Med reduktion menas tagande av elektron
Cu2+ + 2 e- 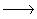 Cu Reduktion
Cu Reduktion
7. Vad är en redoxreaktion?
Svar: En redoxreaktion beskriver en oxidation och en reduktion som sker samtidigt. En oxidation kan inte ske utan att en reuktion sker. Det är lite svårt för en atom att lämna över en elektron om ingen tar emot den.
Fe + Cu2+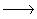 Fe2+ + Cu Redoxreaktion
Fe2+ + Cu Redoxreaktion
8. Vad menas med korrosion?
Svar: Ordet korrosion betyder fräta på latin. Ämnena fräts eller löses upp. De flesta material kan utsättas för korrosion men vanligt är det metaller som vi menar att de korriderar. Korrosion är ett stort problem. Både vad gäller vid tillverkning av bilar, båtar, flygplan och varmvattenberedare. Man måste hela tiden hålla koll på så att man inte skapar ett så kallat galvaniskt element. Detta är extra viktigt då fukt eller andra typer av lösningar kommer att vara närvarande. Om en rörmokare skall koppla samman två rör måste han tänka på att inte koppla samman rör av olika metaller. På bilden nedan har en rörmokare kopplat samman ett järnrör med ett kopparrör. I röret kommer vatten att rinna. Vattnet kommer att fungera som en elektrolytlösning. Järn som är mindre ädelt än koppar kommer att lämna elektroner till kopparjonerna. Järnatomerna blir då joner. Rost uppstår.
9. Vad är ett galvaniskt element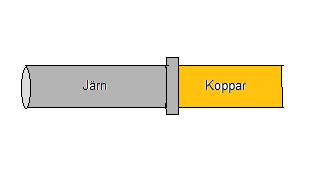
Svar: ett galvaniskt element består av olika metaller som på något vis är sammankopplade. För att skapa ett galvaniskt element krävs dessutom en elektrolytlösning. Elektronerna kommer att vandra från den oädla metallen till den ädla metallen. Det uppstår korrosion.
På lektionen har du fått göra ett eget galvaniskt element. I bilden nedan ser du en annan form av galvaniskt element än det som gjordes på lektionen. I bägaren finns kopparjoner och sulfatjoner. En zinkplatta och en kopparplatta är nedsänkt i lösningen. Båda plattorna är sammanlänkade med en ledare och där mellan en voltmeter. Sulfatjonerna är så kallade åskådarjoner.
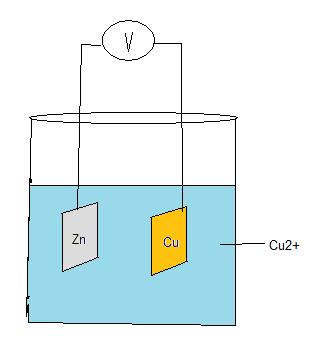
I spänningsserien ovan kan man utläsa att koppar är mer ädelt än zink. Zink har större benägenhet att vara i jonform än koppar. Därför är det zink som ger elektroner till kopparn. Elektronerna går via ledaren, genom voltmetern. Det överskott av elektroner som bildas vid kopparplattan avges till kopparjonerna i lösningen.
På detta vis bildas en elektrisk spänning.
Zinkplattan blir minuspol (katod) och kopparplattan blir pluspol (anod).
För att reaktionen skall ske måste det finnas joner i lösningen. Jonlösningen kallas för elektrolyt. Jonerna för elektrolyter.
Om vi då tittar på hur man skapar spänning ur en citron, så fungerar citronsaften som elektrolytlösning. Detta är möjligt då citronsaften innehåller bland annat syror som fungerar som elektrolyter. Genom att stoppa in olika metaller i citronen får man på det viset ett galvaniskt element
10. Hur fungerar ett vanligt batteri?
Svar: Jo, precis som jag visat ovan. Alla batterier måste ha någon form av elektrolytlösning. Salmiak är vanlig i dag då det är miljövänligt. Dock har man blandat i gelatin för att den inte skall vara rinnande. Som pluspol brukar batterier ha en kolstav och som minuspol ett tunnt hölje av zink. När man använder batteriet t.ex. i en ficklampa, kommer atomerna i zinkhöljet att övergå till joner i salmiaklösningen. När zinkhöljet sedan är slut, är batteriet också slut. I ett batteri finns det flera lager av olika material för att innehållet i batteriet inte skall läcka ut.
11. Hur kan man skydda metallföremål från att rosta?
Svar: För att skydda t.ex. bilplåt eller annan metall från att oxidera kan man ytbehandla med hjälp av elektrolys. En metall man ofta använder är förzinkning. Man brukar också kalla denna metod för galvanisering. Vanlig spik brukar täckas med ett lager zink. Det underliggande järnet blir på detta vis skonat från korrosion under lång tid framöver. Vill man bekläda oädla metaller med en finare yta av t.ex. guld eller silver går det också bra. Då använder man silverjoner eller guldjoner i stället för zink. Så här går metoden till.
Ett annat exempel är offeranoder. En bit oädel metall (ofta zink) som man sätter på ett föremål så att de skall rosta. När tex en järnyta utsätts för en oxidation tas elektronerna från järnatomerna. Egentligen skulle järnatomerna ombildats till joner om nu inte zinkatomerna (offeranoden) lämna över motsvarande mängd elektroner till järnatomerna. På detta vis kommer zinkatomerna att oxideras i stället.
12. vad är en alaktrolys och hur fungerar den?
Svar: genom en elektrolys kan jag bekläda en metallyta med andra typer av atomer. Vill jag tex bekläda en järnstav med silver atomer använder jag en jonlösning med silverjoner. Genom att koppla spänning till järnstavarna kommer de positiva silverjonerna att ta emot elektroner vid den negatiiva katoden. När jonerna tar emot elektroner övergår de till att bli atomer i stället som sätter sig utanpå järnstaven.
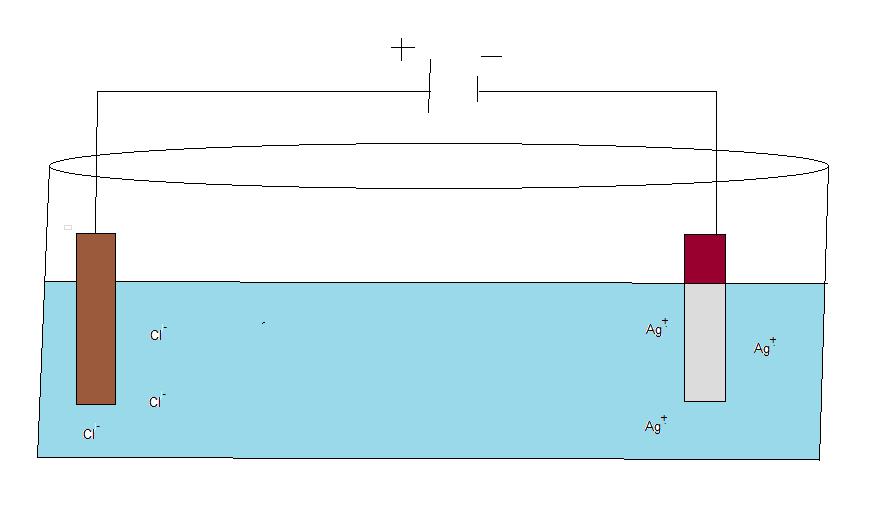
Vid en elektrolys har man positiva och negativa joner i lösning. Genom att sätta på spänning kommer jonerna att dra sig till motsatta laddning. I exemplet ovan låter jag järnstavar bada i en elktrolytlösning av silverjoner och klorjoner. När jag kopplar på spänning får jag två poler. De negativa klorjonderna kommer att vandra till den positiva polen medans de positivt laddade silverjonerna vandra till den negativa polen. Vid den positiva polen kommer klorjonerna att lämna en elektron och det bildas då klorgas. vid den negativa polen kommer silverjonerna att ta upp en elektron och då bilda silveratomer på ytan av järnstaven. På detta vis kan jag tvinga jonerna att övergå till atomer även vid mindre ädla metaller.