|

Syror och Baser
När man hör ordet syra tänker man nästan alltid direkt på de farliga starka syrorna. Men visst är det så att det är de svaga syrorna som är de vanligaste i vår omgivning. Du hittar svaga syror i frukter, maten, och mediciner. Naturen producerar sina egna syror och ger alla frukter sin typiska surhet i smaken.
Alla syror innehåller väte
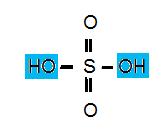
Om du tittar på strukturformlerna nedan ser du att alla syrorna har atomen väte gemensamt.
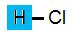
Saltsyra Ättiksyra
Svavelsyra
När en syra "fräter" lämnar de ifrån sig sina väten. I kemin kallar vi dessa väten för protoner.
HCl + H2O --> H3O+ + Cl-
Saltsyra + Vatten --> oxoniumjon + klorjon
Svaga syror
De svaga syrorna är inte lika farliga som de starka men kan ändå irritera hud och slemhinnor. Syrorna har länge använts i matlagning som ett konserveringsmedel. Bakterierna som gör att maten blir fördärvad med tiden trivs inte i sur miljö. Det som skiljer svaga syror från starka syror är att deras protoner inte avges lika lätt.
Om du blandar saltsyra i vatten kommer nästan alla saltsyramolekyler att avge sina protoner. Löser du en svag syra kommer denna reaktion att ta mycket längre tid och därför är svaga syror mindre reaktiva än starka syror.
Ex på svaga syror
Askorbinsyra = vitamin C
vinsyra = används i saft och sylt
acetylsalicylsyra
Saltsyra HCl
Saltsyra är en av de starka syror vi använder oss av. Saltsyrans molekyl består av en väteatom samt en kloratom. Saltsyra används tilll mineralfoder för husdjur men fungerar samtidigt mycket bra till tvättning av husfasader samt rengörning av metaller då man vill ta bort metalloxider.
Saltsyra i koncentrerad form är färglös men sticker i näsan om man andas in den. Detta beror på att koncentrerad saltsyra gärna går upp i gasform.
Vi har en del saltsyra i magen. Denna används för att vi ska kunna bryta ned maten vi äter.
När du späder saltsyra med vatten bildas följande joner.
H2O + HCl --> H3O+ + Cl-
Vatten + saltsyra --> Oxoniumjon + klorjon
Svavelsyra H2SO4
Svavelsyra är uppbyggt av en svavelatom, 4 syre atomer och två väteatomer som släpper när syran fräter. Titta man på syran är den färglös men mer trögflytande än de andra syrorna vi arbetar med i kemin.
De syror vi har i kemin är utspädda med vatten. Dvs de är inte koncentrerade. När man späder svavelsyra är det viktigt att man gör det i rätt ordning. Man häller alltid i syran i vattnet när man späder. Anledningen till detta är att alla svavelsyramolekylerna kommer att lämna från sig sina väten (Protoner) och då är det bra om man bara tillför lite svavelsyra i taget. Känner man på bägaren som man spätt syran i är den betydligt varmare än när den var innan man spädde syran.
SIV-regeln Syra I Vatten
När man späder svavelsyra i vatten bildas följande joner
H2O + H2SO4 --> H3O++ HSO4-
Vatten + svavelsyra --> oxoniumjon + vätesulfatjon
Vätesulfatjonen är en svag syra men kan avge sitt enda väte till en bas.
Svavelsyra är en viktig kemikalie Den används i tillverkningen av gödsel, färgämnen och sprängämnen som nitroglycerin. Den används också när man skall tillverka saltsyra och fosforsyra.
Salpetersyra HNO3
Salpetersyra är också en färglös vätska. Som du kanske märkt har jag denna syra i en mörk flaska. Det är för att syran reagerar på ljus och faller då sönder. Detta kan man märka om syran är gulfärgad.
När man späder salpetersyra i vatten bildas följande joner
H2O + HNO3 --> H3O+ + NO3-
vatten + salpetersyra --> Oxoniumjon + nitratjon
Nitrösa gaser är inte nyttiga att andas in. Salpersyra har egenskapen att bilda sådana när de låter reagera med vissa metaller.
Störst användning har man av salpetersyra när man skall tillverka amoniumnitrat som är ett gödsel. Man kan också ha salpetersyra till sprängämnen.
4 Viktiga baser
Man brukar säga att alla syror avger vätejoner (protoner). På samma sätt kan du säga att alla baser tar till sig vätejoner (protoner).
Natriumhydroxid NaOH
Natriumhydroxiden består av en natriumatom, en syreatom samt en väteatom. I hemmet kan man ha den till att lösa proppar i avloppet. När man köper den i butiken kallas den för kaustiksoda. Natronlut är natriumhydroxid löst i vatten.
Som vi sett på lektionen är natriumhydroxid i fast form ett vitt pulver. På vårt laboratorium har vi natriumhydroxiden som små pastiller (tabletter).
Natriumhydroxid löst i vatten (natronlut) är mycket frätande och får man det på sig är det viktigt att omedelbart tvätta sig. Får man det i ögonen måste man skölja noga med vatten samt kontakta en läkare.
Industriellt används matriumhydroxiden till i pappersmassafabrikerna samt till tvålframställnng
Soda Na2CO3
Ett annat namn för soda är natriumkarbonat. Soda ingår i tvättmedel då det är smutslösande. En annan egenskap som sodan har är att den löser kalksalter som gör vattnet hårt. på detta vis får tvättmedlet större effekt på smutsen.
Ett stort användningsområde för soda är glastillverkning. Genom att tillsätta soda till sand sänks smältpunkten för sanden.
Kalciumhydroxid Ca(OH)2
Denna bas har man bland annat när man luta långan till jul. Kalciumhydroxiden löst i vatten kallas för kalkvatten. Blåser man koldioxid i lösning blir lösningen grumlig. På detta vis kan man använda kalciumhydroxid som indikatorlösning på koldioxidgas.
Ammoniak NH3
Ammoniak löser sig lätt i vatten. Den ammoniak vi har i skolan är ammoniak i gas som lösts i vatten. I och med att den gärna går upp i gasform är det viktigt at tänka på att ha denna i dragskåp. Den ger från sig en stark stickande doft som är direkt farlig att inandas då den angriper slemhinnorna och lungorna.
Ammoniak har en låg kokpunkt -33,4 grader celcius. Därför används ammoniak i flytande form som kylmedel i större kylanläggningar. Ammoniak används industriellt till gödselproduktion och i tillverkningen av salpetersyra.
Hydroxidjonen OH-
Det som är generellt för samtliga baser som lösts i vatten är att det bildas hydroxidjoner.
NH3 + H2O --> NH4+ + OH-
ammoniak + vatten --> ammoniumjon + hydroxidjon
Sura och basiska lösningar
Generellt kan man säga att alla sura lösningar har H3O+ jonen gemensamt och alla basiska lösningar har OH- jonen gemensamt.
Nedan jämför jag hur en sur lösning bildas och vilka jonslag som ingår med en basisk lösning.
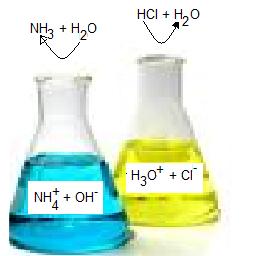
I den gula e-kolven har jag lagt i saltsyra och vatten. Saltsyrans väte avgår till vattenmolekylen H2O som då blir H3O+. + laddningen hos H3O+ bildas då det endast är väteatomens kärna som avges och den är ju positivt laddad. Vätets enda elektron stannar hos kloratomen som då får en elektron extra och blir negativt laddad Cl-.
I den blå e-kolven löser jag ammoniak och vatten. Ammoniak tar gärna en proton från vattenmolekylen. Vattenmolekylen behålller vätets enda elektron och blir OH-.Ammoniakmolekylen blir därigenom NH4+. Ammoniakmolekylen fick en proton till och den är ju positivt laddad, därför blir ammoniumjonen också det.
Neutral lösning
I sura lösningar finns det alltså gott om H3O+. Det är dessa man mäter när man vill få ett pH-värde på en lösning. Kemister brukar säga att man mäter vätejonskoncentrationen. Detta är en liten felsägning då det egentligen inte finns vätejoner i lösningen utan bara oxoniumjoner. Vätejonen är så reaktiv att den endast kommer att existera någon mikrodels sekund.
I en neutral lösning finns det lika många H3O+ som OH-. pH för en sådan lösning är 7. Sura lösningar är under sju och basiska lösninga ligger på H mellan 7-14
Indikatorer
En indikatator är ett ämne som reagerar på sura och basiska lösningar. I kemiundervisningen har du varit i kontakt med två stycken indikatorer, BTB och fenolftalein.
Båda dessa ändrar färg beroende på om det är en basisk eller sur lösning.
BTB i sur, neutral och basisk lösning

Bilden är från wikipedias artikel om BTB
Fenolftalein från vänster pH mindre än 0, till höger pH mer än 12
|