|
Översätt Till övningsuppgifterna

Kemisk bindning

Målbeskrivning
Ett tips när du läser målbeskrivningen är att titta på skillnaden i den fetmarkerade texten när du jämför kraven för de olika betygsstegen.
För betyget E krävs,
- Samtala om frågor som rör energi, hälsa och miljö.
- Skilja mellan fakta och värderingar
- Formulera enkla motiveringar samt beskriva konsekvenser.
- Formulera egna frågor och kunna bemöta åsikter och argument som till viss del för en diskussion framåt.
- Använda olika källor för att söka information samt kunna föra till viss del underbyggda resonemang kring källors trovärdighet.
-Kunna använda information till enkla texter med viss anpassning till ett syfte
- Utifrån egen planering kunna genomföra en egen undersökning. Eleven skall bidra till ett formulera enkla frågeställningar som går att arbeta systematiskt utifrån. Elev användeer utrustning och kemikalier i huvudsak på ett säkert och fungerande sätt.
- Eleven skall kunna jämföra resultaten med frågeställningen och dra enkla slutsatser med viss koppling till modeller och teorier.
-Föra enkla resonemang kring resultatens rimlighet och bidra till att ge förslag på hur man kan förbättra en undersökning.
- Eleven skall kunna göra enkla dokumentationer av undersökningar med tabeller, diagram och bilder i skriftliga rapporter.
- Eleven skall ha grundläggande kunskaper om materiens uppbyggnad, oförstörbarhet och omvandlingar och kunna visa detta genom att ge exempel på och beskriva dessa med viss användning av kemins begrepp, modeller och teorier.
- Eleven kan föra enkla och till viss del underbyggda resonemang om kemiska processer i levande organsimer, mark, luft och vatten och visar då på enkelt identifierbara kemiska samband i naturen.
- Kunna undersöka hur några kemikalier och kemiska processer används i vardagen och beskriver då enkelt identifierbara kemiska samband och ger exempel på energiomvandlingar och materiens kretslopp.
- Eleven skall kunna föra enkla och till viss del underbyggda resonemang kring människans användning av energi och naturresurser påverkar miljön och visar på några åtgärder som bidrar till en hållbar utveckling.
- Eleven skall kunna beskriva och kunna ge exempel på naturvenskapliga uptäckter och deras betydelse för människornas levnadsvillkor
För betyget C krävs
- Samtala om frågor som rör energi, hälsa och miljö.
- Skilja mellan fakta och värderingar
- Formulera utvecklade motiveringar samt beskriva konsekvenser.
- Formulera egna frågor och kunna bemöta åsikter och argument på ett sätt som för diskussionen framåt.
- Använda olika källor för att söka information samt kunna föra utvecklade och relativt väl underbyggda resonemang kring källors trovärdighet.
-Kunna använda information med relativt enkla texter med anpassning till ett syfte.
- Utifrån egen planering kunna genomföra en egen undersökning. Eleven skall bidra till ett formulera enkla frågeställningar som det efter någon bearbetning går att arbeta systematiskt utifrån. Elev använder utrustning och kemikalier på ett säkert och ändamålsenligt sätt.
- Eleven skall kunna jämföra resultaten med frågeställningen och dra utvecklade slutsatser med relativt god koppling till modeller och teorier.
-Föra utvecklade resonemang kring resultatens rimlighet och ger förslag på hur man kan förbättra en undersökning.
- Eleven skall kunna göra utvecklade dokumentationer av undersökningar med tabeller, diagram och bilder i skriftliga rapporter.
- Eleven skall ha goda kunskaper om materiens uppbyggnad, oförstörbarhet och omvandlingar och kunna visa detta genom att förklara och visa på samband inom dessa med relativt god användning av kemins begrepp, modeller och teorier.
- Eleven kan föra utvecklade och relativt väl underbyggda resonemang om kemiska processer i levande organsimer, mark, luft och vatten och visar då på förhållandevis komplexa kemiska samband i naturen.
- Kunna undersöka hur några kemikalier och kemiska processer används i vardagen och beskriver då förhållandevis komplexa kemiska samband samt förklara och visa på samband mellan energiomvandlingar och materiens kretslopp.
- Eleven skall kunna föra utvecklade och relativt väl underbygda resonemang kring människans användning av energi och naturresurser påverkar miljön och visar på fördelar och begränsningar hos några åtgärder som bidrar till en hållbar utveckling.
- Eleven skall kunna förklara och visa på samband mellan några naturvenskapliga uptäckter och deras betydelse för människornas levnadsvillkor
För betyget A krävs
- Eleven kan samtala om och diskutera frågor som rör energi, miljö, hälsa och samhälle och skiljer då fakta från värderingar och formulerar ställningstaganden med välutvecklade motiveringar samt beskriver några tänkbara konsekvenser. I diskussionerna ställer eleven frågor och framför och bemöter åsikter och argument på ett sätt som för diskussionerna framåt och fördjupar eller breddar dem.
- Eleven kan söka naturvetenskaplig information och använder då olika källor och för välutvecklade och väl underbyggda resonemang om informationens och källornas trovärdighet och relevans.
- Eleven kan använda informationen på ett väl fungerande sätt i diskussioner och för att skapa välutvecklade texter och andra framställningar med god anpassning till syfte och målgrupp.
- Eleven kan genomföra undersökningar utifrån givna planeringar och även formulera enkla frågeställningar och planeringar som det går att arbeta systematiskt utifrån. I undersökningarna använder eleven utrustning på ett säkert, ändamålsenligt och effektivt sätt.
- Eleven kan jämföra resultaten med frågeställningarna och drar då välutvecklade slutsatser med god koppling till kemiska modeller och teorier.
- Eleven för välutvecklade resonemang kring resultatens rimlighet i relation till möjliga felkällor och ger förslag på hur undersökningarna kan förbättras och visar på nya tänkbara frågeställningar att undersöka. Dessutom gör eleven välutvecklade dokumentationer av undersökningarna med tabeller, diagram, bilder och skriftliga rapporter.
Eleven har mycket goda kunskaper om materiens uppbyggnad, oförstörbarhet och omvandlingar och andra kemiska sammanhang och visar det genom att förklara och visa på samband inom dessa och något generellt drag med god användning av kemins begrepp, modeller och teorier.
- Eleven kan föra välutvecklade och väl underbyggda resonemang om kemiska processer i levande organismer, mark, luft och vatten och visar då på komplexa kemiska samband i naturen.
- Eleven undersöker hur några kemikalier och kemiska processer används i vardagen och samhället och beskriver då komplexa kemiska samband och förklarar och generaliserar kring energiomvandlingar och materiens kretslopp. Dessutom för eleven välutvecklade och väl underbyggda resonemang kring hur människans användning av energi och naturresurser påverkar miljön och visar ur olika perspektiv på fördelar och begränsningar hos några åtgärder som kan bidra till en hållbar utveckling.
- Eleven kan förklara och generalisera kring några centrala naturvetenskapliga upptäckter och deras betydelse för människors levnadsvillkor-
Atomnummer
För att göra det enklare att se hur många protoner en atom har i sin kärna har man gett varje atom ett atom nummer. Kollar man i periodiska systemet ser man att litium har atomnumret 3, 3Li. Den nedsänkta trean framför den kemiska beteckningen är atomnumret och säger alltså hur många protoner det finns i atomkärnan.
Atommodellen
Ett vanligt sätt att illustrera en atom är med det som jag kalla planetsystemet. En atom har en kärna med två olika partiklar, protoner som är positivt laddade och neutroner som är neutrala i sin laddning, eller rättare sagt saknar den laddning. Alla atomer är neutralt laddade och när kärnan är positivt laddad ser man att det måste finnas en negativ partikel hos atomen. Elektronerna runt kärnan är negativt laddade. När jag illustrerar atomen som ett planetsystem placerar jag elektronerna i olika elektronskal på olika avstånd från kärnan beroende på vilken energinivå varje elktron besitter.
Atomens partiklar
Proton Positivt laddad
neutron Neutral
elektron Negativt laddad
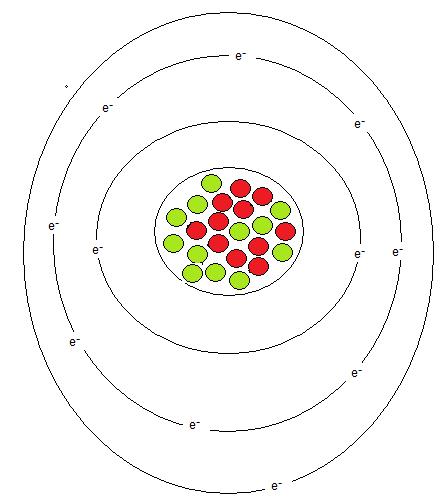
De röda prickarna är protoner och de gröna är neutroner. Kärnan är alltså positivt laddad. Runt kärnan kretsar negativa elektroner. Antal protoner och elektroner är samma i antal vilket gör att atom i sig är neutral i sin laddning. Här visas K, L och M-skal.
Elektronskalen
De negativa elektronerna kretsar runt atomkärnan i olika elektronskal beroende på energinivå. De innersta skalet heter K-skalet. I K-skalet får det max plats för 2 elektroner. Nästa skal heter L-skalet. I L-skalet får det max plats 8 elektroner. Det tredje skalet heter M-skalet. Beroende på om det finns ett skal till utanför får det plats 8 eller 18 elektroner. Om det alltså finns ett N-skal utanför M.skalet får det plats 18 elektroner i M skalet annars bara 8 elektroner.
Grupper och perioder i det periodiska systemet
Atomer som har samma egenskaper är i samma grupp. De har lika många elektroner i sitt yttersta skal. Grupperna är lodräta, de grundämnen som finns i grupp 1 är här blåfärgade. Ämnen inom samma period har lika många elektronskal, vågrät. I detta fall har jag färgat dem rödrosa.
I det periodiska systemet har man ordnat alla våra grundämnen från det minsta till det största. Manä även placerat alla grundämnen efter hur många elektroner de har i sitt yttersta skal samt hur många elektronskal de har.
Alla grundämnen indelas dessutom i metaller och icke metall. Detta betyder att antingen är ämnet en metall eller en icke metall. det finns förstås mer ingående indelning men detta räcker för högstadiet.
Grundämnesfamilj
Grundämen som har samma egenskaper sitter i samma grupp. Man brukar också benämna dessa grupper som grundämnesfamiljer.
Alkalimetaller
Grupp 1 med en elektron i det yttersta skalet. Du kommer att bli bekant med tre av dessa. Litium, Natrium och kalium. Metallerna är mjuka och det går lätt att skära med kniv. De är metaller med en klar glänsande yta. Samtliga alkalimetaller har en valens elektron vilket gör att de gärna gör sig av med denna. De reagerar lätt med bland annat vatten och klor.
Halogener
Halogenerna är ickemetaller och tillhör grupp 17. De har 7 elektroner sitt yttersta skal. Då alla atomer strävar efter fulla skal behöver de endast en elektron till. Detta gör halogenerna mycket reaktiva. Flour, klor, brom och jod är några av dem som man finner i denna grupp. Du känner till de flesta av dem. Klor har man i dricksvatten och bassänger. Flour används till munsköljning. Jod använder man när man skall sterilisera inför operationer eller som sårrengörning bland annat till hästar
Ädelgaser
Grupp 18 är ädelgaser. De har 8 elektroner i sitt yttersta skal och har därmed fulla yttersta skal. De är således helt oreaktiva vilket betyder att de gärna inte medverkar i några kemiska reaktioner. Observera att Radon finns med bland ädelgaserna. Radon är radioaktivt vilket betyder att dess atomkärna faller sönder och bildar radioaktiv strålning och är därför farlig av den anledningen. Ädelgas används flitigt till ljusrör i reklamskyltar men också i vanliga glödlampor. Hade man haft vanlig luft i glödlamporna hade syret i luften reagerat med glödtråden varvid glödtråden hade brunnit upp.
Ädelgasstruktur
Alla atomer strävar efter en stabil struktur. Detta innebär att de vill ha en så låg energinivå som möjligt. Genom att ha fulla elektronskal skapa de sig en stabil struktur, de blir därmed oreaktiva och ingår ogärna i kemiska reaktioner. Ädelgaserna har denna struktur och därmed namnet.
Hur bildas molekyler
Som du redan vet kommer alla våra gasformiga grundämnen i tvåpack (utom ädelgaserna). Varför gör dem det?
Jo vi titta på vätgas till höger bilden nedan:

Bilden är från https://oa1.wikispaces.com/file/view/MolekylbindningV%C3%A4te.png/31217285/MolekylbindningV%C3%A4te.png
Väteatomen har en proton i kärnan (blåfärgad) och en elktron i K-skalet. Väteatomen saknar därför en elektron för att uppnå ädelgasstruktur. Genom att slå sig samman med en anna väteatom , delar de på de två elektronerna och de båda atomerna tror att de uppnått ädelgasstruktur. Båda atomerna delar lika på elektronerna, vilket betyder att elektronen är lika mycket hos de båda atomkärnorna. Det uppstår en kovalent bindning.

När jag tittar på vattenmolekylen består den av två väteatomer och en syreatom. Väteatomen saknar en elektron i sitt yttersta skal för att uppnå ädelgasstruktur. Syreatomen har sex elektroner i sitt yttersta skal. Den behöver två elektroner till för att uppnå ädelgasstruktur. Genom att syreatomen ger en kemisk reaktion och binder ihop med två väteatomer kommer syreatomen tro att den har ädelgasstruktur. Detsamma gäller för de båda väteatomerna. Titta på vattenmolekylen och räkna hur många elektroner du finner i varje skal.
Valenselektron
De elektroner som finns i det yttersta skalet kallas för valenselektroner
Vad är en jon
Joner kan sägas vara atomer som har mer eller mindre elektroner än vad de har protoner i kärnan. På detta vis blir atomerna laddade. Strävan efter ädelgasstruktur gör att atomer antingen ta till sig eller lämnar från sig elektroner. Det är på detta vis de få olika antal protoner och elektroner
Väteatomen har en elektron i sitt yttersta skal. (se bilden nedan) Den har också en proton i kärnan. Väteatomen är alltså neutralt laddad. Väteatomens strävan att uppnå ädelgasstruktur gör att den kastar sin enda elektron. Kvar blir endast en positiv proton.
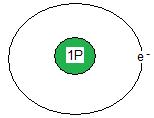 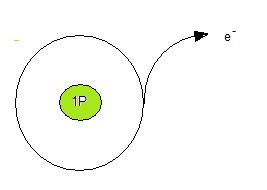
Väteatomens proton brukar man skriva som H+. Alla positiva joner kallas för katjoner.
Kloratomen har sju valenselektroner och behöver en elktron till för att uppnå ädelgasstruktur. Då den gör det får den en elktron mer än den har protoner. altså fler minus än plus. Kloratomen blir på detta vis en negativ jon. Negativa joner kallas för anjoner. Se bilden nedan.
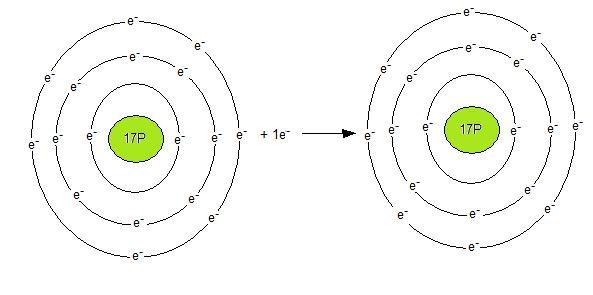
Klorjonen har 18 elektroner men endast 17 protoner. Klorjonen skrivs som Cl-.
Hur bildas jonföreningar
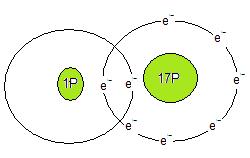
När atomer strävar efter att bilda ädelgasstruktur kommer atomerna att leta upp andra atomer som kan antingen ta upp eller ge från sig elekroner. I detta fall låter jag väteatomen reagera med kloratomen. kloratomen kommer att ta till sig väteatomens elektron. Elektronenerna i bindningen är mer hos kloratomen än hos väteatomen. Lite orättvis fördelning kan man tycka men samtliga atomer ur grupp 17 är elktronegativa och är sådana att de gärna tar till sig elektroner. Sådana atomer bildar gärna jonföreningar. Lägger man en jonförening i ett lämpligt lösningsmedel kommer bindningen att släppa mellan atomerna. Kloratomen tar då vätets enda elektron och bildar då klorjoner och vätejoner. Vätejoner existerar endast ett kort ögonblick. Vätejoner bildar t.ex. oxoniumjoner i vatten. Dessa skrivs som H3O+.
|